
发表期刊:Advanced Functional Materials
IF:19
一作单位:南方医科大学第十附属医院
研究背景
免疫疗法通过靶向免疫检查点阻断(ICB)技术,重新激活潜伏的癌症免疫系统,实现全身性的肿瘤清除。然而,95%的结直肠癌(CRC)病例在微卫星不稳定性检测中呈阴性,这会引发免疫系统的严重抑制和T细胞的大量消耗,从而形成免疫抑制性肿瘤微环境(ITM),并导致对ICB所用的单抗产生低过敏性免疫反应。PD-1/PD-L1抗体耐药性产生的重要因素在于T细胞免疫球蛋白黏蛋白-3(TIM3)的上调。作为新型免疫检查点分子,TIM3不仅能抑制T细胞活性,还能特异性破坏HMGB1诱导肿瘤细胞免疫性死亡的能力。
CRISPR/Cas13a是一种RNA核酸内切酶,除了作为强大的RNA编辑工具外,还具有开发成癌症治疗系统的潜力。在crRNA引导下特异性识别后,Cas13a会对目标基因实施强效RNA沉默,并通过独特的“旁系切割效应”进一步促进肿瘤细胞死亡,有效抵抗肿瘤的应激反应逃逸机制。Cas13a系统靶向RNA而非基因组DNA,因此不会引发额外的突变。此外,Cas13a在靶向单链RNA转录前不具备切割活性,这使得通过筛选肿瘤中过表达的目标基因,能够实现高度的生物安全性。尽管CRISPR/Cas13a在多靶点癌症治疗中优势显著,但为了避免体内持续激活的Cas13a高剂量递送带来的安全风险,仍需实现精准的肿瘤定位。受小分子自组装前药体系的启发,具有“无载体”递送特性的纳米前药能够有效解决载药量低、渗透性差、稳定性不足、药代动力学特征不佳及副作用严重等缺陷。此外,纳米组装体有利于与两亲性染料结合,从而构建出一体化的诊疗系统。
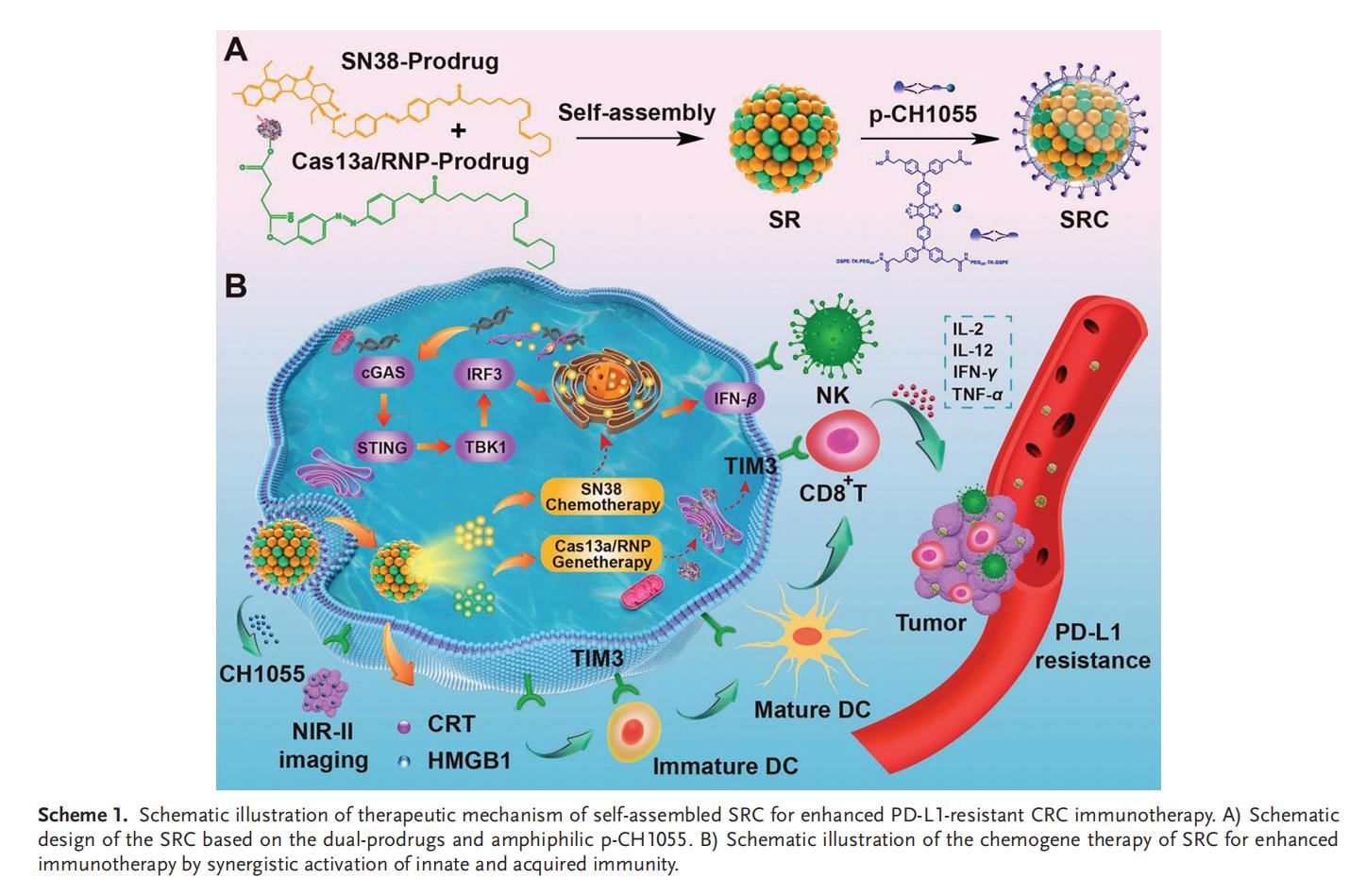
实验结果
1.SRC的制备和表征
本研究设计了一种级联自解纳米组装体(SRC),其核心是由SN38前药与靶向TIM3的Cas13a/RNP前药自组装形成的超分子纳米复合物(SR),在外层包裹低浓度两亲性的DSPE-TK-PEG-CH1055(p-CH1055)作为纳米系统表面涂层。亚油酸与偶氮苯的共轭作用促进了SN38和Cas13a/RNP的自组装及控释,而琥珀酸酐的引入则增强了Cas13a/RNP的结合能力。聚不饱和脂肪酸无需外源辅料即可实现自组装,其中亚油酸还被证实能确保集成自组装体系在体内保持高稳定性,避免快速解聚和代谢。通过将疏水性CH1055转化为两亲性探针的p-CH1055,不仅实现了肿瘤成像功能,还显著提升了SRC的体内稳定性、生物相容性和药代动力学特性。
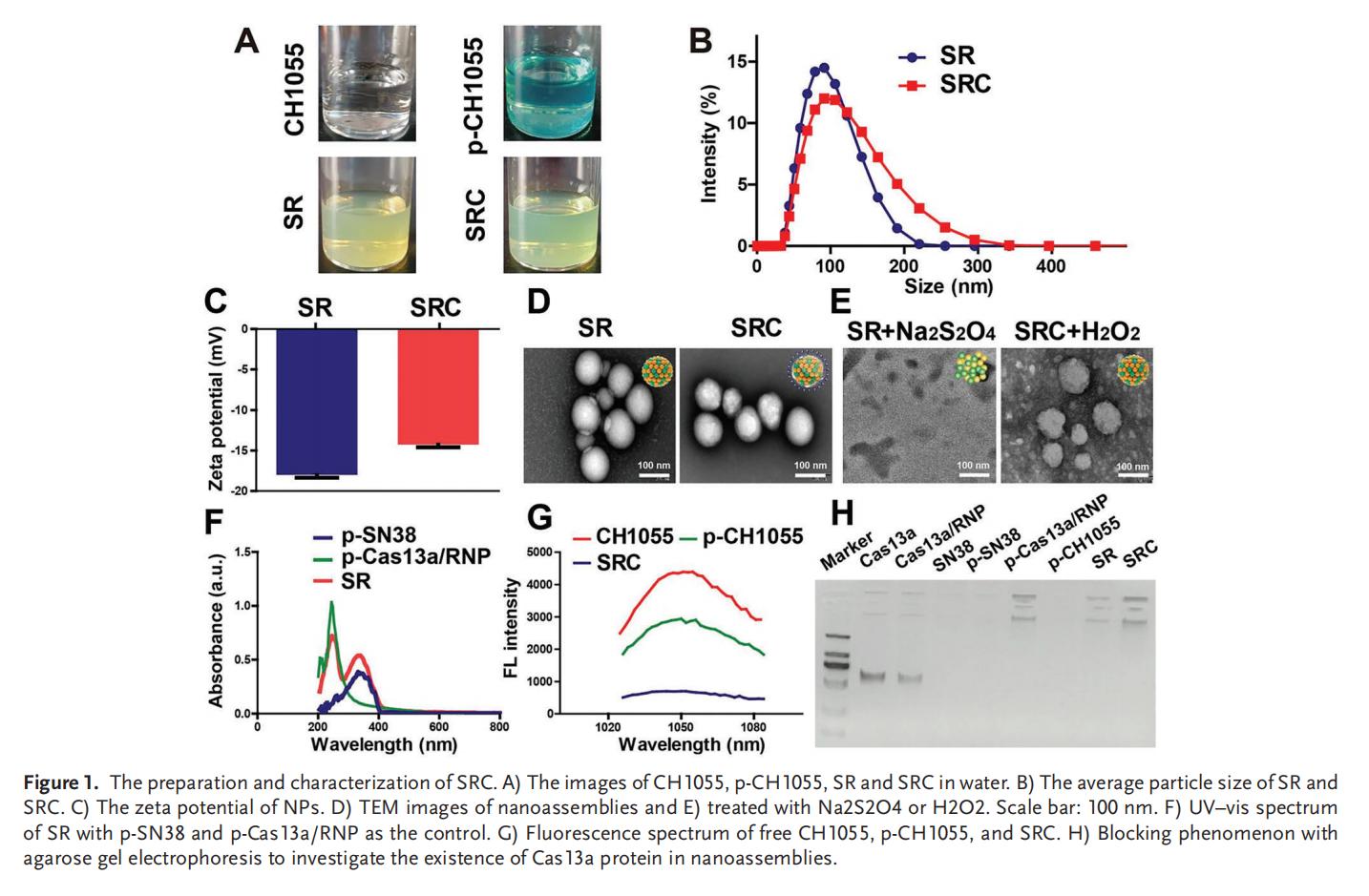
2.SRC的级联自解与稳定性
从“外壳”到“核心”的级联自解过程始于对高活性氧(ROS)肿瘤微环境的响应,SRC在首次自解时释放游离的CH1055,实现肿瘤的近红外II(NIR-II)成像并阻止荧光淬灭;在第二次自解时,由缺氧环境刺激SN38和Cas13a/RNP实现靶向控释。
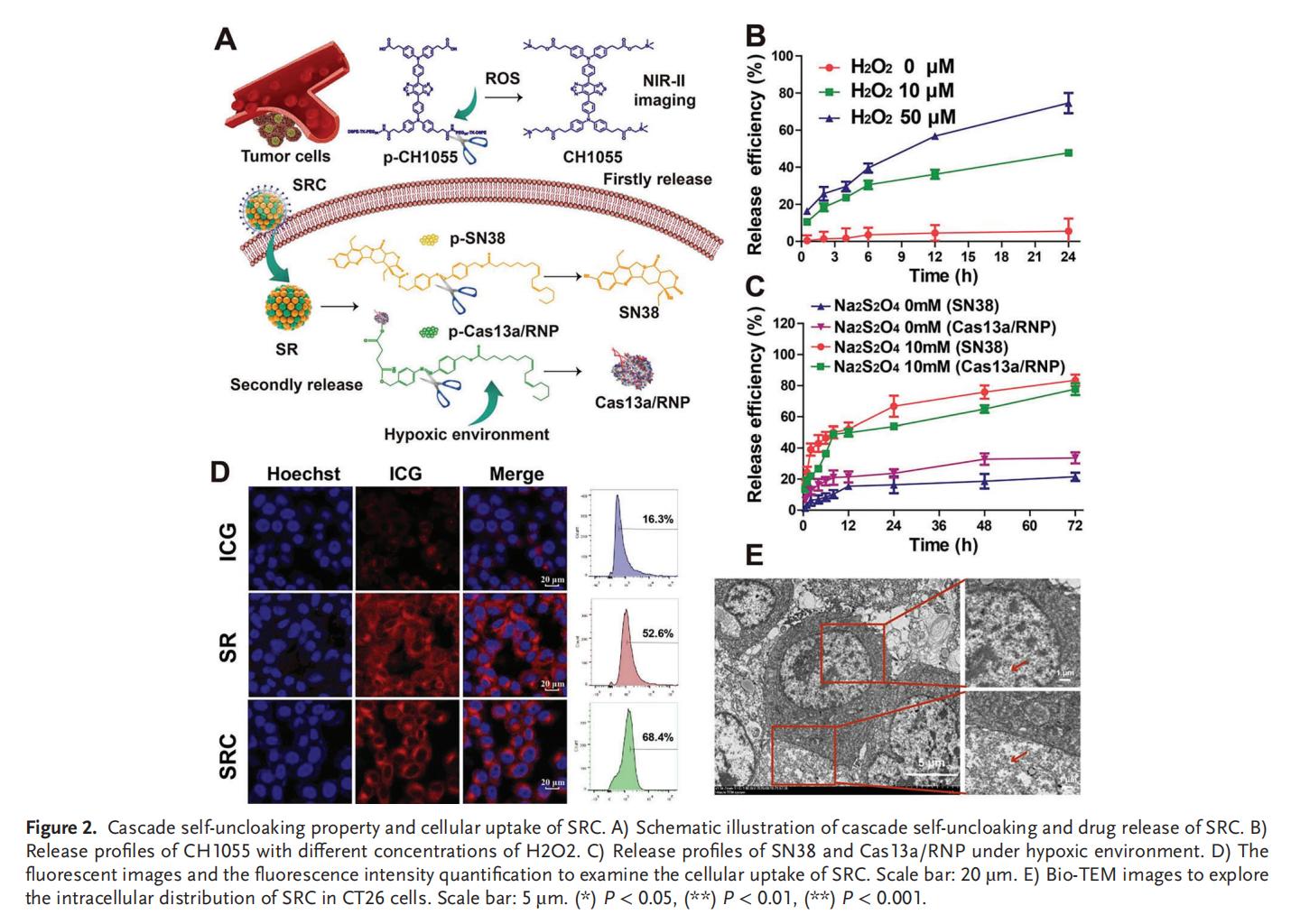
3.SRC和RNA编辑的高效细胞摄取
Cas13a/RNP在SRC中具有高活性,Cas13a核糖核蛋白复合物(RNP)的功能性和高RNA编辑效率使其能够被应用于癌症治疗。此外,SRC在RNA的编辑效率上优于siRNA和脂质转染,这种差异可能源于纳米系统更强的细胞摄取能力。
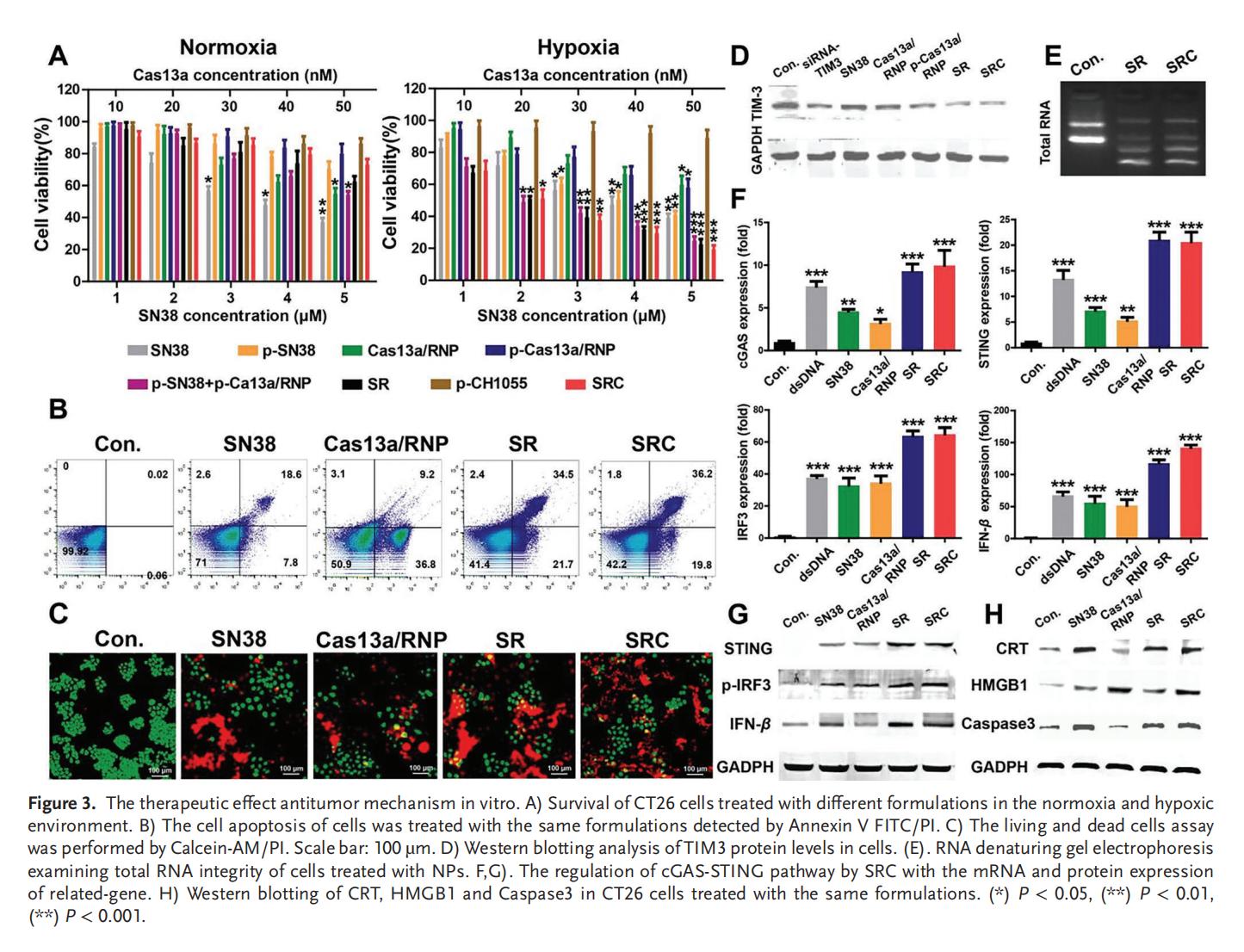
4.SRC的细胞毒性及抗肿瘤作用机制
Cas13a能够通过高效的RNA降解显著抑制TIM3的表达。SN38和Cas13a/RNP均能调控STING信号通路,显著上调STING通路的相关蛋白,并且相较于单独使用,SRC组合表现出更显著的协同激活效应。此外,SRC通过激活CRT、HMGB1及Caspase 3等诱导免疫细胞死亡效应,证实了SRC对低氧CRC细胞的体外疗效,为CRC的治疗提供了初步依据。
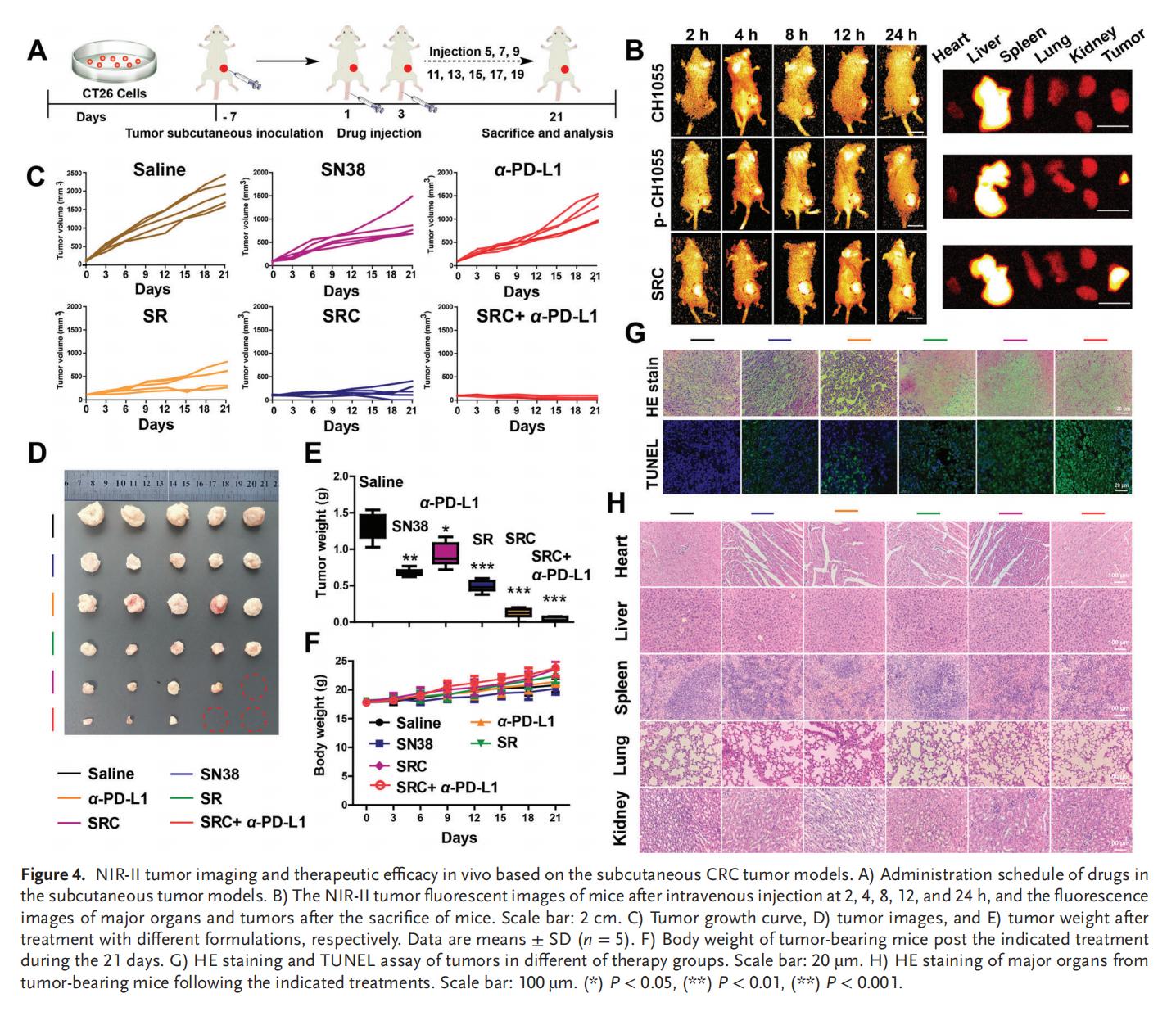
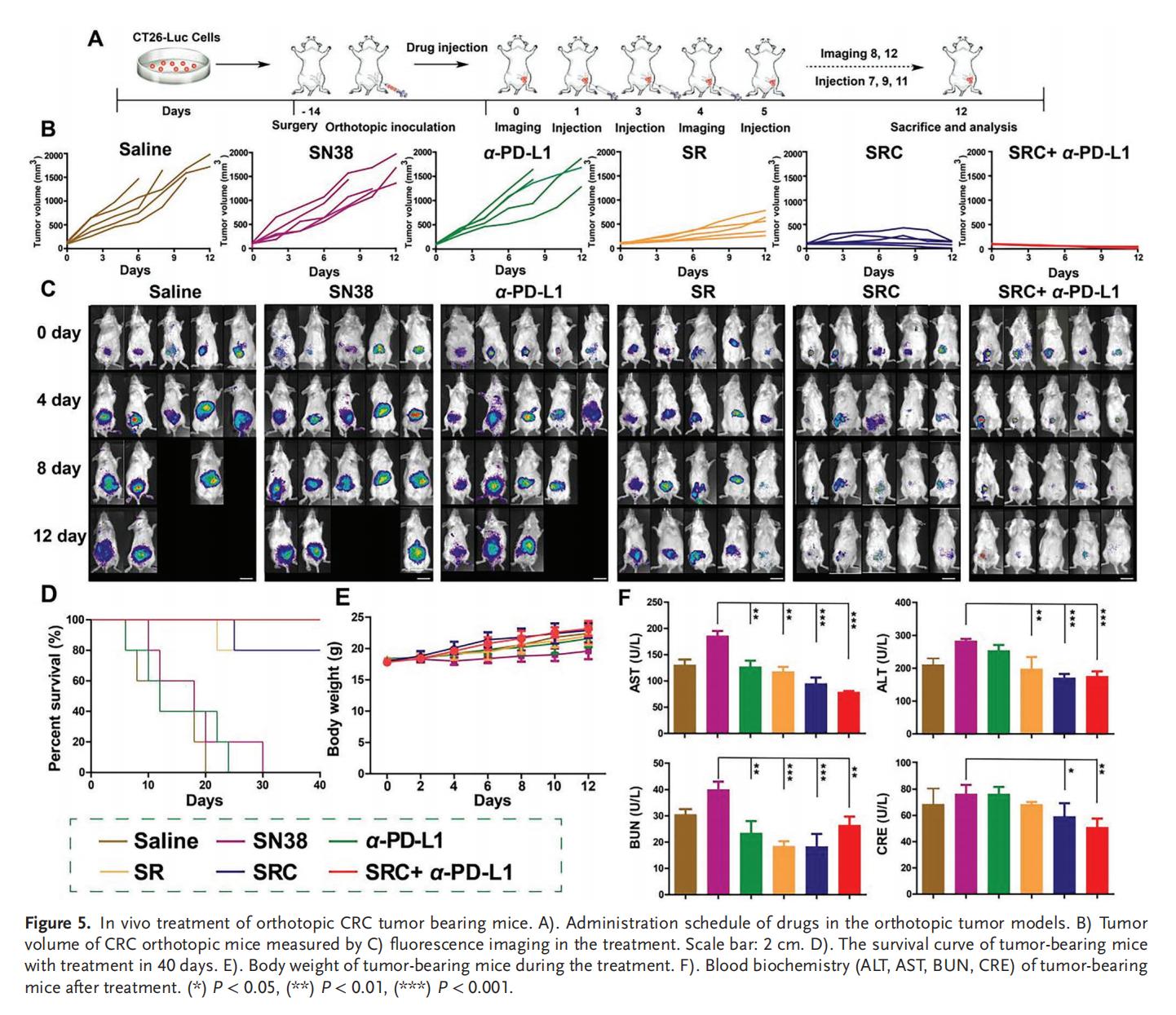
5.PD-L1耐药CRC的体内治疗
单独使用SN38或α-PD-L1治疗仅表现出轻微的抗肿瘤效果,而SRC+α-PD-L1联合治疗则展现出最佳的肿瘤抑制效果,肿瘤细胞死亡率和凋亡水平以及小鼠存活率均显著优于单独使用游离药物或SR,并且具有极高的生物安全性。SRC优异的治疗效果和生物安全性表明其作为新型辅助治疗策略,在增强PD-L1靶向ICB疗法治疗CRC方面具有巨大潜力。
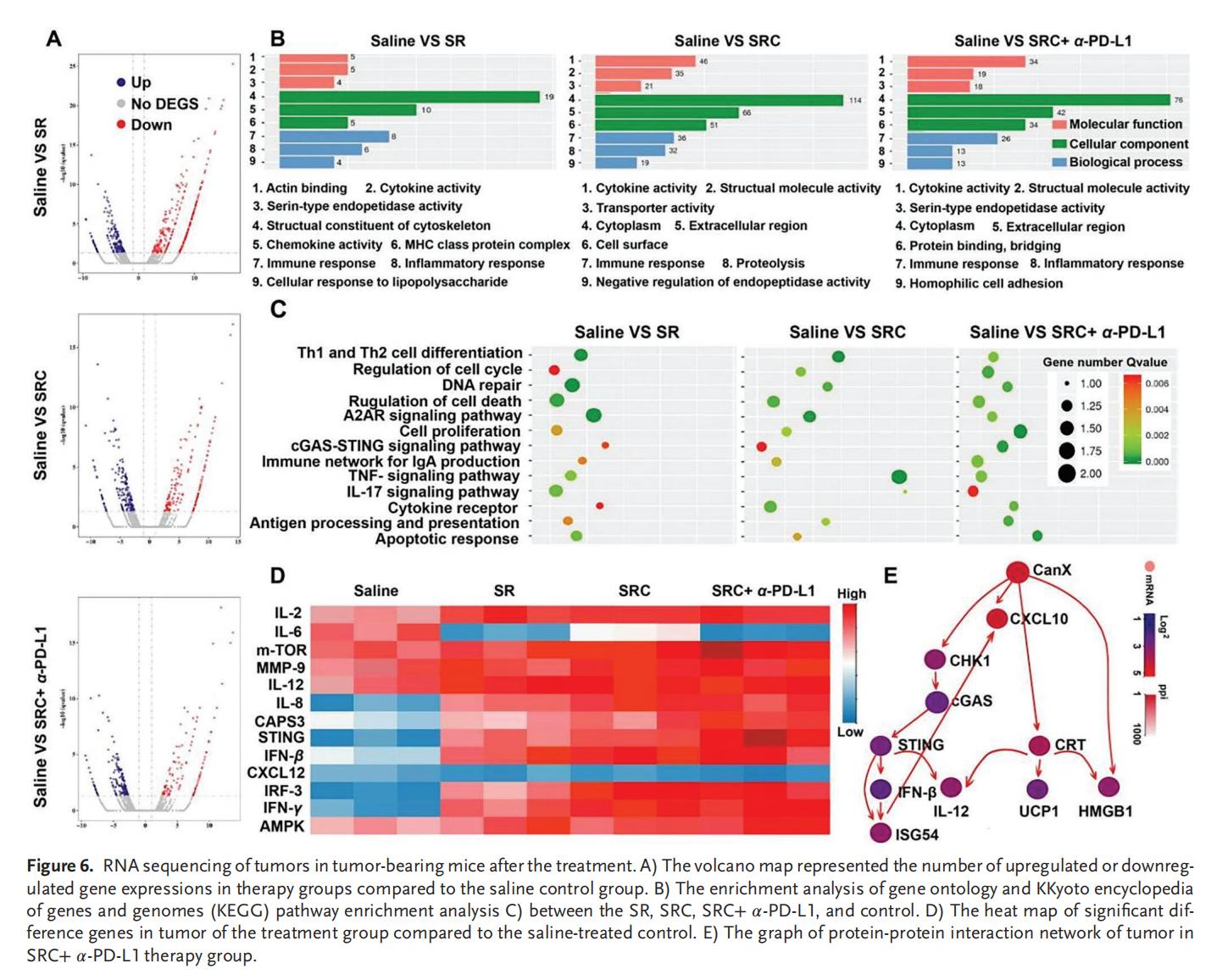
6.RNA测序分析
SRC对免疫激活和趋化因子分泌起到同样的促进作用,通过上调多种基因的转录水平,有效激活免疫系统,此过程涉及多种信号通路,包括与Th1和Th2细胞分化相关的免疫通路、IgA生成、细胞因子受体、A2AR及IL-17信号传导,以及细胞周期调控、细胞增殖、细胞死亡、细胞凋亡相关通路等。此外,SN38的免疫原性细胞死亡(ICD)效应可以诱导DNA修复,不仅参与调控cGAS-STING信号通路,还影响抗原的加工与呈递过程,为免疫系统提供特异性肿瘤抗原。SRC+α-PD-L1联合治疗在先天性免疫和获得性免疫中均表现出了协同效应,通过先天性免疫系统与适应性免疫系统的多效联合作战,促进细胞毒性T淋巴细胞浸润肿瘤,逆转ITM效应,从而有效抑制肿瘤生长。
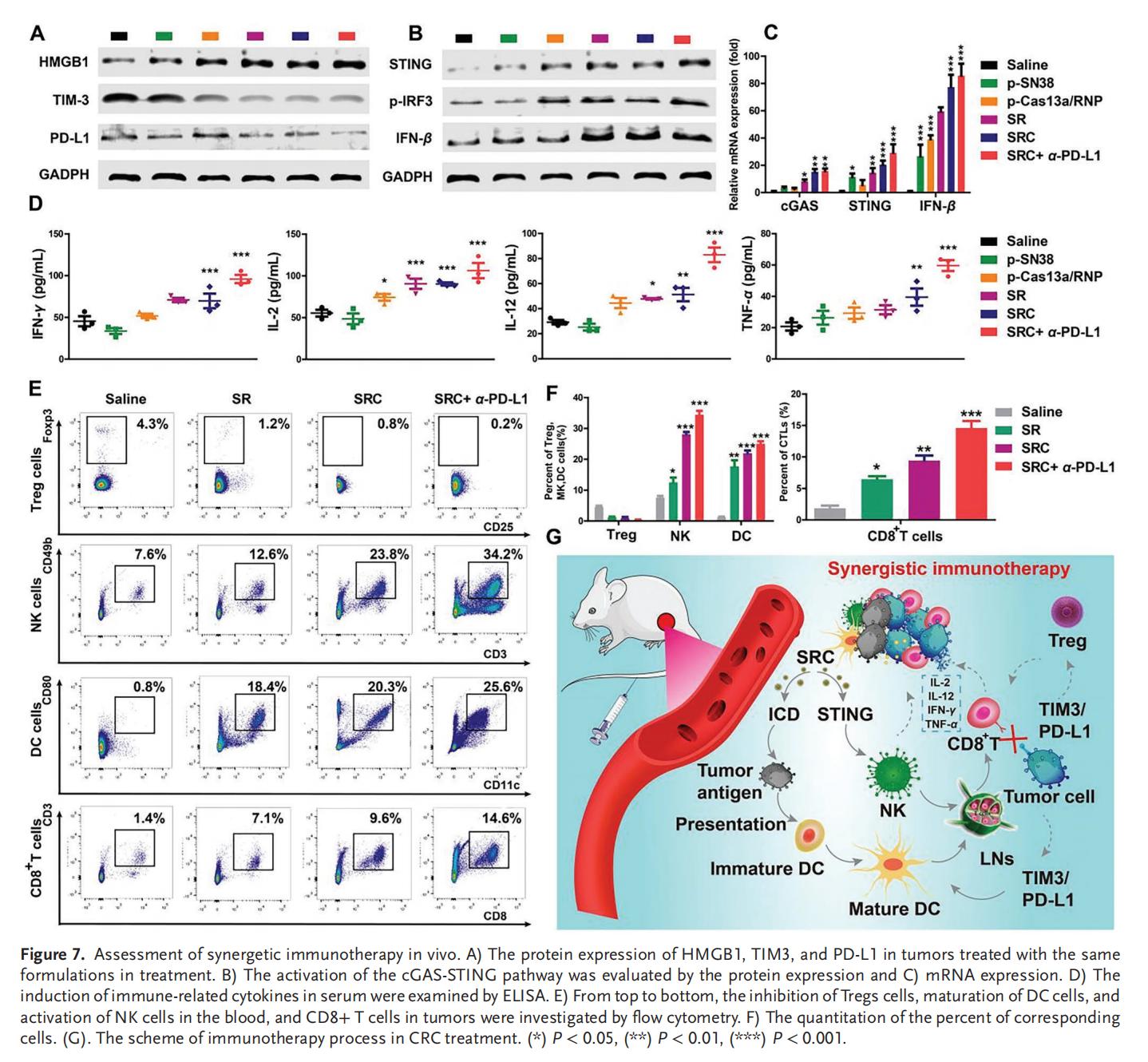
7.联合治疗的协同免疫激活
SN38诱导肿瘤细胞DNA断裂,并触发NK细胞活化和树突状细胞成熟。基于SN38与TIM3基因编辑技术的SRC组合疗法具有显著的免疫协同效应,SRC作为新辅助治疗方案与已获批的PD-L1靶向临床药物联用时展现出优异的疗效。该策略通过先天免疫与获得性免疫的联合作战为高效的免疫治疗开辟了新途径,有望突破CRC的ITM及PD-L1耐药性,实现彻底治愈。
结论
本研究开发了一种基于SN38与Cas13a/RNP双前药的级联自解纳米组装体SRC,通过包裹ROS响应探针实现外部封装。SRC不仅稳定性优异,还能根据肿瘤微环境的高ROS和低氧特性实现级联自解响应:该探针在肿瘤微环境中被激活后,会因解离为单分子而触发CH1055的近红外II期成像,在缺氧环境中的二次自解可实现SN38和Cas13a/RNP的靶向控释。
在体外实验中,SRC成功实现了CRC细胞的高效摄取和靶向基因编辑。Cas13a蛋白通过旁系切割效应,有效抑制了癌细胞增殖并诱导其凋亡。此外,在PD-L1耐药的原位和异种移植模型中,SRC展现出优异的CRC抑制效果,通过增强CTL介导的肿瘤免疫浸润,显著提升α-PD-L1抗体在体内的治疗效果。SRC还能诱导细胞介导的ICD,激活cGAS-STING先天免疫通路,促进树突状细胞成熟、NK细胞增殖,通过靶向调控新型免疫检查点TIM3的RNA编辑技术,协同激活先天性和适应性免疫系统,显著改善ITM。
总之,SRC为SN38化疗与TIM3基因治疗的联合应用提供了高效策略,这种结合方案有望在降低副作用的同时增强PD-L1抗体治疗效果。因此,该技术在未来PD-1耐药CRC的临床治疗中具有良好的应用潜力。

